Les Produits de Traitement du Pied d'Athlète
Date
2024-09-27
Avant-Propos
Cette monographie a pour objet de remplacer la Monographie sur le traitement du pied d'athlète datée du 7 décembre 2018. La présente monographie décrit les exigences nécessaires à l'obtention d'une autorisation de mise sur le marché, à savoir d'un numéro d'identification de médicament (DIN) ou d'un numéro de produit naturel (NPN) pour des produits pour le traitement du pied d'athlète. La monographie indique les ingrédients médicinaux et non médicinaux autorisés, les concentrations, les indications, et les instructions et conditions relatives à l'utilisation de ces produits qui peuvent être homologués sans soumission de données supplémentaires auprès de Santé Canada. Les produits qui ne répondent pas aux critères énoncés dans le présent document peuvent faire l'objet d'une demande d'autorisation de mise en marché en dehors du cadre de la présente monographie.
Les demandeurs sont priés de noter que les produits de traitement du pied d'athlète, comme tout médicament sans ordonnance ou produit de santé naturel, sont assujettis au Règlement sur les aliments et drogues ou au Règlement sur les produits de santé naturels administré par la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Ces règlements comprennent les exigences liées à l'étiquetage, à la fabrication et aux spécifications du produit. Toute information supplémentaire apparaissant sur les étiquettes, mais non spécifiée dans la monographie, telles des instructions supplémentaires et/ou des allégations non thérapeutiques, est acceptable pour autant qu'elle satisfasse aux Lignes directrices destinées à l'industrie des médicaments en vente libre et des cosmétiques concernant les allégations non thérapeutiques acceptables pour la publicité et l'étiquetage, aux Lignes directrices sur la publicité des produits de santé destinée aux consommateurs pour les médicaments en vente libre, les produits de santé naturels, les vaccins et les instruments médicaux, et qu'elle ne soit ni fausse, trompeuse ou contre-intuitive en ce qui a trait à l'utilisation du produit.
Notes:
- Le texte entre parenthèses correspond à des renseignements complémentaires facultatifs qui peuvent être inclus sur l'étiquette à la discrétion du demandeur.
- La présence d'une barre oblique (/) signifie que les termes et/ou les énoncés sont synonymes. Le demandeur peut sélectionner l'un ou l'autre terme ou énoncé sur l'étiquette.
Ingrédients médicinaux
Les produits de traitement du pied d'athlète sont classés parmi les produits de santé naturels (PSN) s'ils contiennent seulement un ou plusieurs des ingrédients énumérés au tableau 1. Les demandeurs qui sollicitent un PSN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/naturels-sans-ordonnance.html
Les produits de traitement du pied d'athlète sont considérés comme des médicaments sans ordonnance (MSO) s'ils contiennent un ingrédient du tableau 2. Les demandeurs qui sollicitent un DIN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medicaments/demandes-presentations/lignes-directrices.html
Nom(s) propre(s), Nom(s) commun(s), Information(s) d'origine
| Nom(s) propre(s)1 | Nom(s) commun(s)1 | Information(s) d'origine1 | Quantité2 |
|---|---|---|---|
| Matière(s) d'origine - Ingrédient(s) | |||
| Acide 10-undécénoïque |
|
Acide undécénoïque | 10 à 25% |
| Acide 10-undécénoïque, sel de calcium(+2) | Undécylénate de calcium | Undécylénate de calcium | 10 à 25% |
| Acide 10-undécénoïque, sel de cuivre(+2) | Undécylénate de cuivre | Undécylénate de cuivre | 10 à 25% |
| Acide 10-undécénoïque, sel de zinc(+2) | Undécylénate de zinc | Undécylénate de zinc | 10 à 25% |
|
Povidone iodée | Povidone iodée | 10% |
1Au moins une de ces références a été consultée pour les noms propres, noms communs et informations d'origine: BDIPSN 2024; RSC 2023; US FDA 2021; Sweetman 2017.
2Les quantités sont exprimées en pourcentage poids par volume (% p/v). La référence suivante a été consultée pour la quantité: US FDA 2021.
| Nom(s) propre(s) | Nom(s) commun(s) | Quantité |
|---|---|---|
|
Chlorphénésine | 0.5 à 1% |
| 5-Chloro-7-iodo-8-quinolinol |
|
3% |
|
Haloprogine | 1% |
|
Tolnaftate | 1% |
Voie d'administration
Topique
Forme(s) posologique(s)
Formes posologiques acceptables pour les PSN
- Aérosol; Aérosol, pulvérisateur; Aérosol, à dose mesurée; Crème; Écouvillon; Gel; Liquide; Liquide topique; Lotion; Onguent; Pâte; Poudre; Solution; Pulvérisateur; Pulvérisateur, sac sur la valve; Pulvérisateur, à dose mesurée; Pulvérisateur, suspension; Serviette.
Formes posologiques acceptables pour les MSO
- Aérosol; Aérosol mousse; Crème; Écouvillon; Gel; Lotion; Onguent; Pâte; Poudre; Solution; Pulvérisateur; Pulvérisateur, sac sur la valve; Pulvérisateur, à dose mesurée; Serviette.
Usage(s) ou fin(s)
Tous les produits (catégorie I du cadre pour les produits d'autosoins):
- Pour le traitement du pied d'athlète (US FDA 2021).
- Guérit le pied d'athlète (US FDA 2021).
- Tue le champignon qui cause le pied d'athlète (US FDA 2021).
- Soulage (les démangeaisons, la desquamation, la sensation de brûlure, le fendillement, les rougeurs, les douleurs et l'irritation du) (le) pied d'athlète (US FDA 2021).
Produits contenant du tolnaftate
- Prévient le pied d'athlète si utilisé tous les jours chez les personnes ayant une affection récurrente (US FDA 2021).
Dose(s)
Sous-population(s)
Enfants de 2 à 11 ans, Adolescents de 12 à 17 ans, Adultes 18 ans et plus.
Quantité(s)
Voir les tableaux 1 et 2.
Combinaisons permises
Deux ou plusieurs des ingrédients suivants énumérés dans le tableau 1 peuvent être combinés, pourvu que la concentration totale d'undécylénate soit de 10 à 25% :
- acide undécylénique,
- undécylénate de calcium,
- undécylénate de cuivre
- undécylénate de zinc
Mode d'emploi
Tous les produits
- Nettoyer la peau à l'eau et au savon et bien sécher (US FDA 2021).
- Appliquer une mince couche sur la surface atteinte matin et soir pendant toute la durée du traitement de 4 semaines (US FDA 2021).
- Faire attention aux espaces entre les orteils (US FDA 2021).
- Porter des souliers bien ajustés et ventilés ainsi que des bas de coton (US FDA 2021).
- Superviser les enfants durant l'utilisation de ce produit (US FDA 2021).
Produits contenant le tolnaftate avec un usage pour la prévention du pied d'athlète
- Nettoyer la peau à l'eau et au savon et bien sécher (US FDA 2021).
- Pour la prévention, appliquer une mince couche sur les pieds une ou deux fois par jour (US FDA 2021).
- Faire attention aux espaces entre les orteils (US FDA 2021).
- Porter des souliers bien ajustés et ventilés ainsi que des bas de coton (US FDA 2021).
- Superviser les enfants durant l'utilisation de ce produit (US FDA 2021).
Produits en format pulvérisateur, aérosol et poudre
Durée d'utilisation
Aucun énoncé requis.
Mention(s) de risque
Précautions et avertissements
Tous les produits
- Pour usage externe seulement (US FDA 2021).
- Lorsque vous utilisez ce produit, évitez tout contact avec les yeux. Le cas échéant, bien rincer avec de l'eau (US FDA 2021).
- Cessez d'utiliser et consultez un praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé/docteur/médecin si les symptômes s'aggravent ou durent plus de 4 semaines (US FDA 2021).
- Gardez hors de la portée des enfants. En cas d'ingestion, appelez un centre antipoison ou obtenez de l'aide médicale immédiate (US FDA 2021).
Produits contenant de la povidone iodée
Consultez un praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé/docteur/médecin avant l'utilisation si vous avez une maladie de la thyroïde (US FDA 2013).
Contre-indication(s)
Tous les produits
Ne pas utiliser pour les infections des ongles (US FDA 2021).
Produits contenant de la povidone iodée
Ne pas utiliser si vous êtes enceinte ou si vous allaitez (US FDA 2013).
Réaction(s) indésirable(s) connue(s)
Produits contenant de la povidone iodée
De rares cas de réactions anaphylactiques ont été signalés (Gray et al. 2013; Palobart et al. 2009; Yoshida et al. 2008).
Ingrédients non médicinaux
Les ingrédients doivent être sélectionnés à partir de la Base de données d'ingrédients de produits de santé naturels actuelle (BDIPSN), et doivent respecter les seuils indiqués dans cette base de données ainsi que ceux figurant dans le Règlement sur les aliments et drogues et la Liste critique des ingrédients des cosmétiques actuelle, le cas échéant.
Conditions d'entreposage
- Doivent être établies conformément aux exigences décrites dans le Règlement sur les produits de santé naturels ou le Règlement sur les aliments et drogues.
- Si le produit est inflammable ou si le récipient est sous pression, des conditions d'entreposage et des avertissements sont exigés par le Règlement sur les produits chimiques et contenants de consommation.
Spécifications
La présente monographie précise les exigences particulières à la catégorie de médicaments sans ordonnance et aux produits de santé naturels en question. Tout changement apporté au procédé de fabrication ayant un effet sur l'innocuité ou l'efficacité des ingrédients (par exemple, l'usage de nouvelles technologies telle que la nanotechnologie) requiert des données à l'appui qui seront examinées hors du cadre de la présente monographie.
Pour les produits contenant un ingrédient médicinal de PSN du tableau 1
Les spécifications sur les produits finis doivent être établies en accord avec les exigences décrites dans le Guide de référence sur la qualité des produits de santé naturels du DPSSO. Les ingrédients médicinaux doivent respecter les exigences établies dans le BDIPSN
Pour les produits contenant un ingrédient médicinal de MSO du tableau 2
Les produits doivent respecter les exigences du Règlement de la Loi sur les aliments et drogues.
Pour les produits contenant un ingrédient médicinal de PSN du tableau 1:
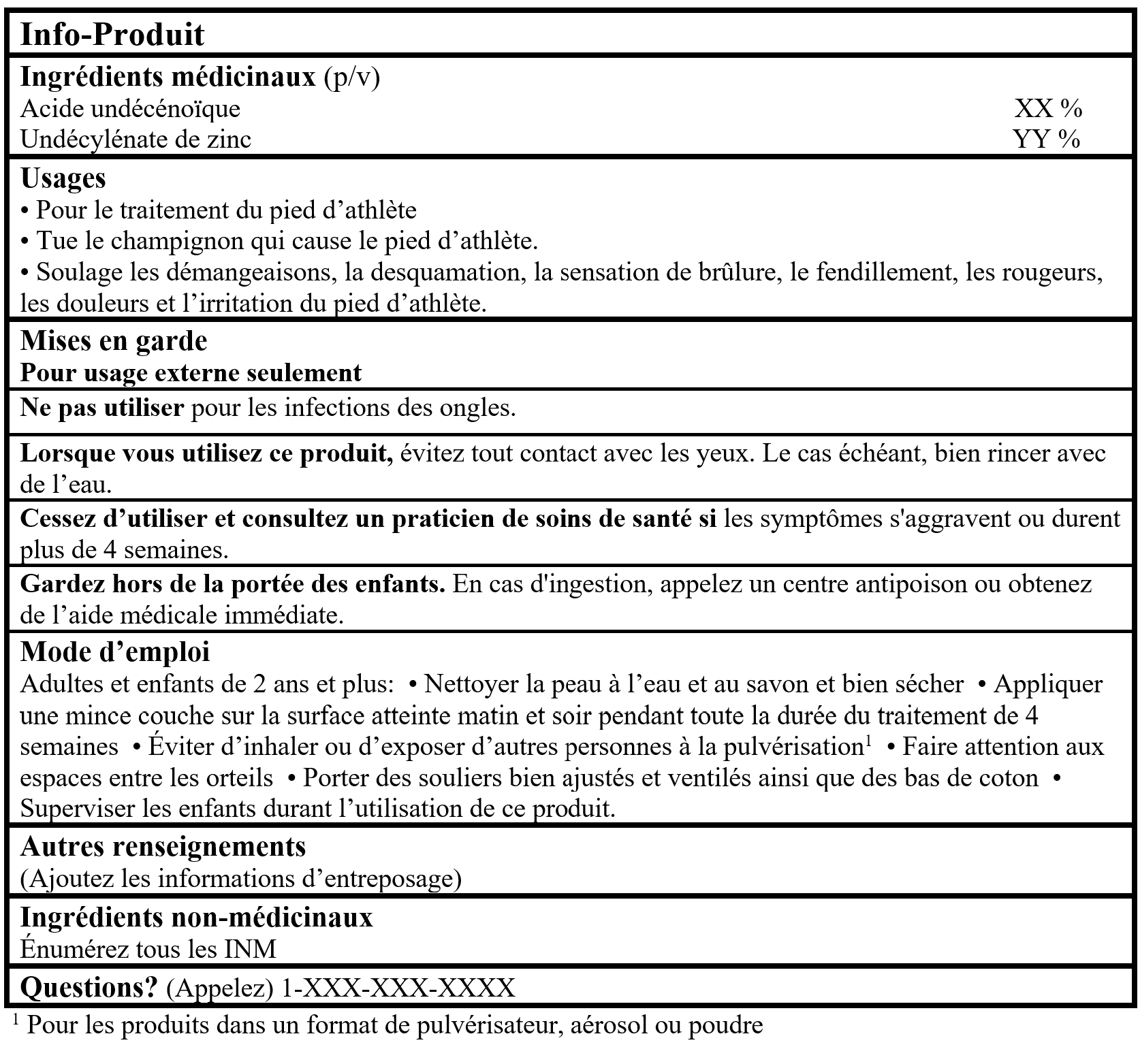
Exemple d'info-produit
Veuillez consulter la ligne directrice, Étiquetage des produits de santé naturels pour plus de détails.
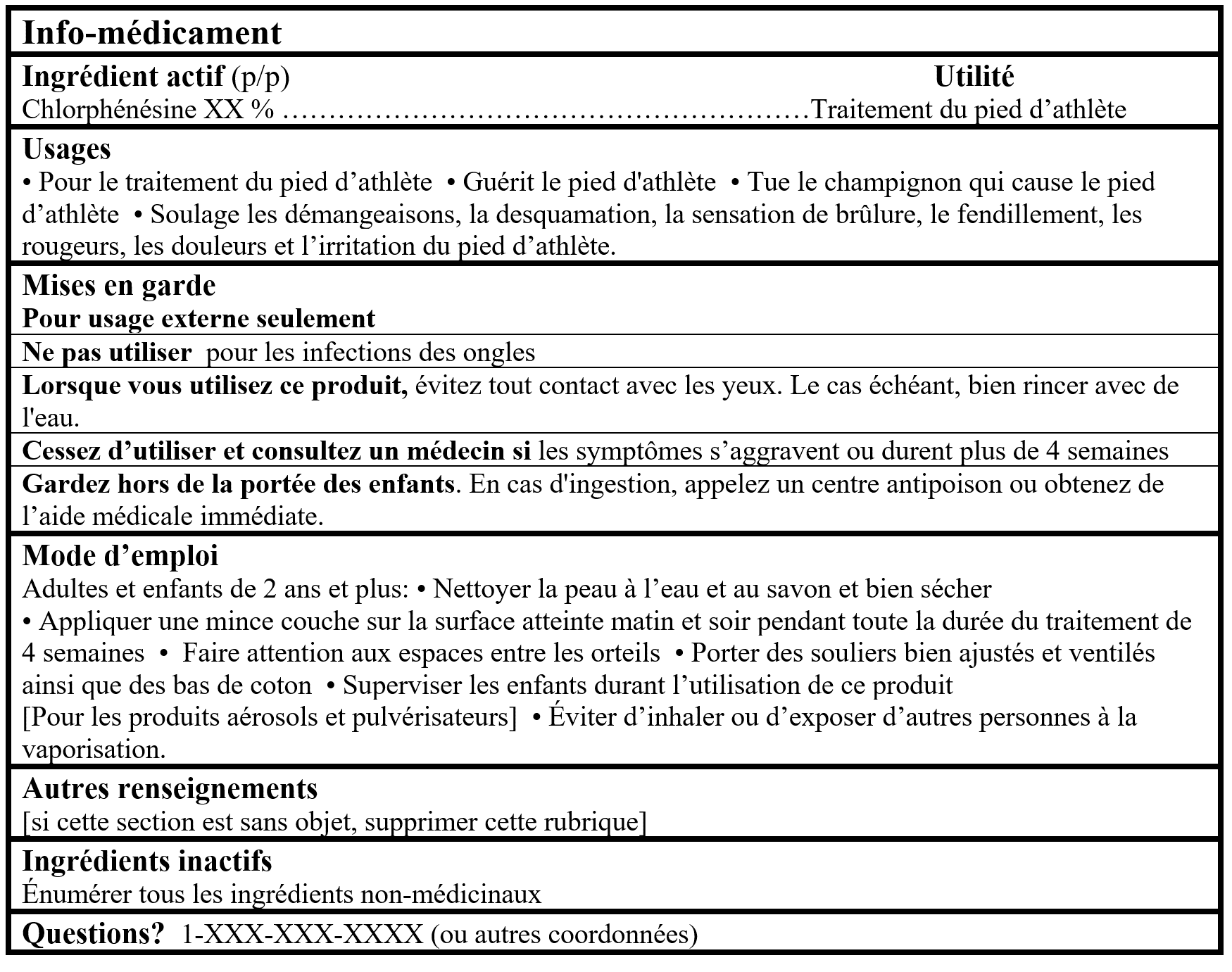
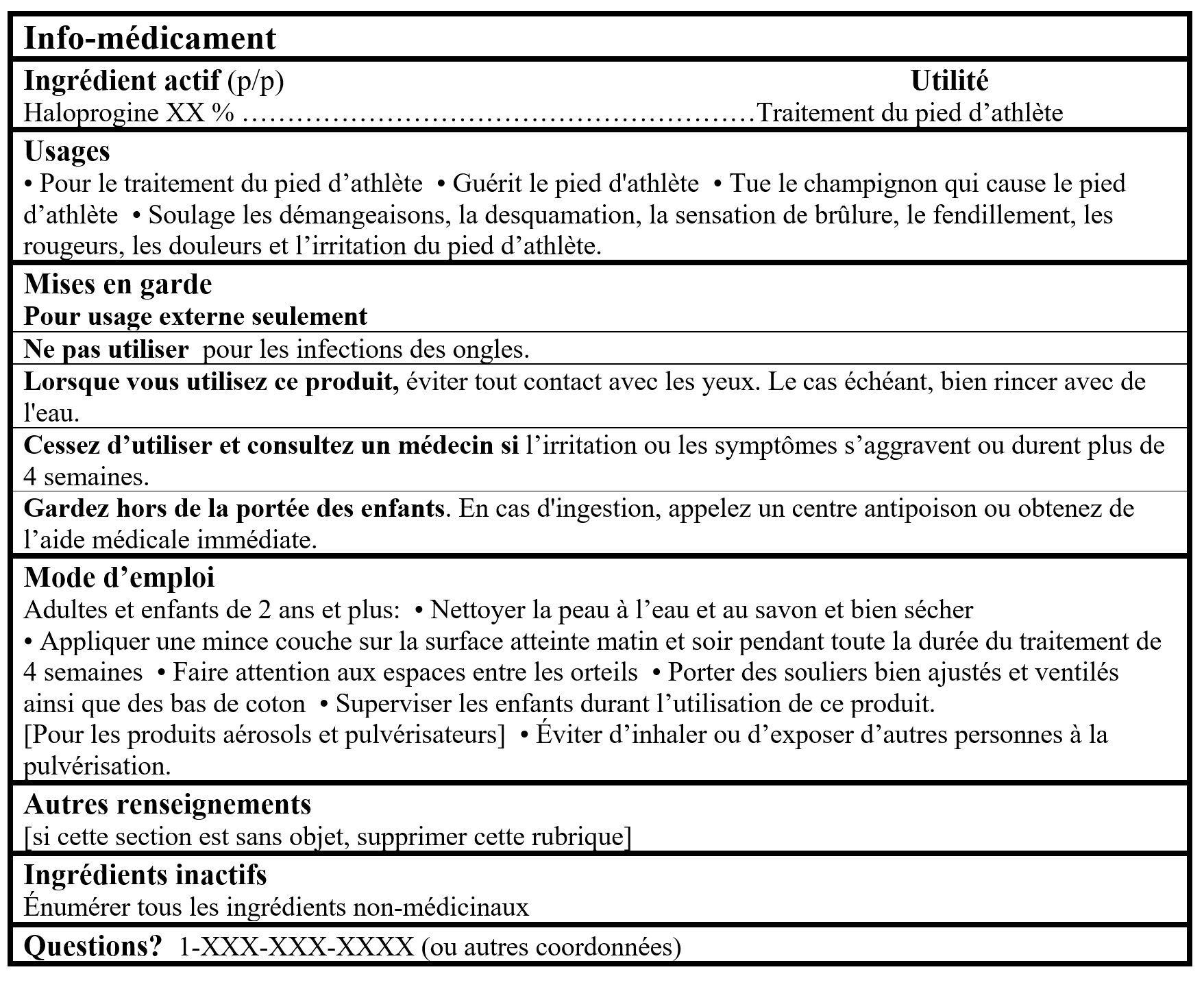
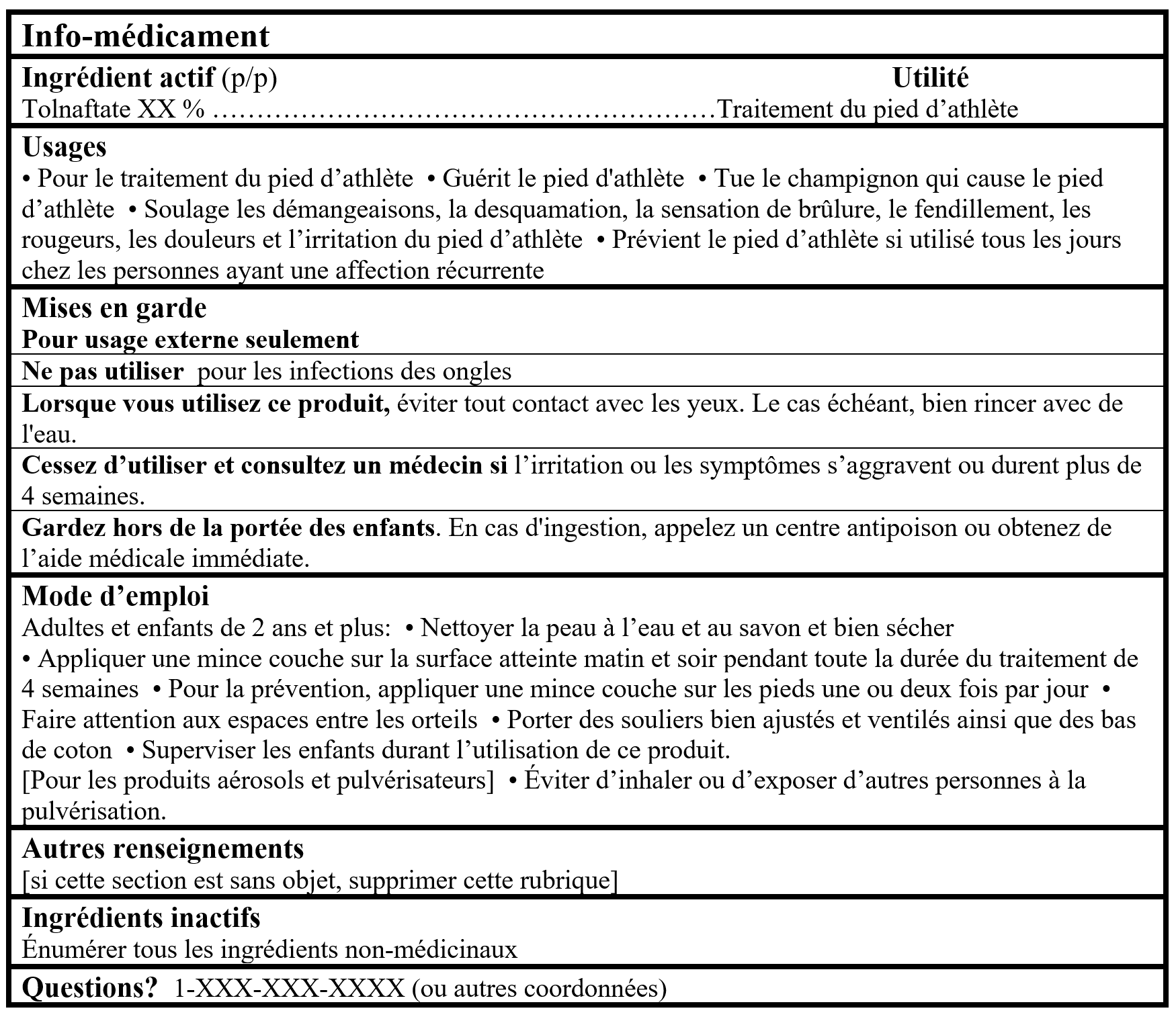
Pour les produits contenant un ingrédient médicinal de MSO du tableau 2:
Tableaux d'Information sur les Médicaments (Format facultatif pour les produits de Catégorie I dans le Cadre pour les produits d'autosoins)

Références
- BDIPSN 2024. Base de données d'ingrédients de produits de santé naturels [Consulté le 28 janvier 2024]. Disponible à : http://webprod.hc-sc.gc.ca/nhpid-bdipsn/search-rechercheReq.do.
- Compendium of therapeutics for minor ailments (CTMA). Power, B, et al., éditeurs. Canadian Pharmacists Association ; 2016.
- Compendium of products for minor ailments (CPMA). Power, B, et al., éditeurs. Canadian Pharmacists Association ; 2016.
- Drug Facts and Comparisons, 2016. Facts and Comparisons Division, Wolters Kluwer; edition 2017 (Oct. 28 2016)
- Drugdex, Micromedex Inc. 2.0
- Goodman and Gilman's The Pharmacological Basis of Therapeutics, 13e édition 2017 Brunton L., Knollmann B., Hilal-Dandan R. McGraw-Hill Education.
- Gray Pe, Katelaris CH, Lipson D. Recurrent anaphylaxis caused by topical povidone-iodine (Betadine). Journal of paediatrics and child health 2013;49(6):506-507.
- Krinsky DL, Ferreri SP, Hemstreet B, Hume AL, Newton GD, Rollins CJ, Tietze KJ. Handbook of Nonprescription Drugs: An interactive approach for Self-Care, 19e édition. Washington (DC): American Pharmaceutical Association; 2017.
- Palobart C, Cros J, Orsel I, Nathan N. Anaphylactic shock to iodinated povidone. Annales françaises d'anesthésie et de réanimation 2009;28(2):168-170.
- Remington's Pharmaceutical Science, 13e édition, 1996, Philadelphia College of Pharmaceutical Sciences
- RSC 2023: Royal Society of Chemistry. The Merck Index Online. [Consulté le 28 janvier 2024]. Disponible à : https://merckindex.rsc.org/.
- Sweetman SC, éditeur. Martindale: The Complete Drug Reference, 39e édition. Grayslake (IL): Pharmaceutical Press; 2017.
- US FDA 2013. Food and Drug Administration des États-Unis. 21 CFR parties 310 et 333. Safety and Effectiveness of Consumer Antiseptics; Topical Antimicrobial Drug Products for Over-the Counter Human Use; Proposed Amendment of the Tentative Final Monograph; Reopening of Administrative Record;. Federal Register, volume 78, numéro 242, 17 décembre 2013. [Consultéle 28 janvier 2024]. Disponible à : https://www.federalregister.gov/documents/2013/12/17/2013- 29814/safety-and-effectiveness-of-consumer-antiseptics-topical-antimicrobial-drug-products-for
- US FDA 2021: U.S. Food and Drug Administration. Over-the-Counter (OTC) Monograph M005: Topical Antifungal Drug Products for Over-the-Counter Human Use. Washington (DC):
- U.S. Food and Drug Administration, Department of Health and Human Services; 2021 [Consultéle 28 janvier 2024]. Disponible à : https://www.accessdata.fda.gov/drugsatfda_docs/omuf/OTC%20Monograph_M005-Topical%20Antifungal%20drug%20products%20for%20OTC%20Human%20Use%2012.16.2021.pdf
- U.S. Food and Drug Administration, Department of Health and Human Services; 2021 [Consultéle 28 janvier 2024]. Disponible à : https://www.accessdata.fda.gov/drugsatfda_docs/omuf/OTC%20Monograph_M005-Topical%20Antifungal%20drug%20products%20for%20OTC%20Human%20Use%2012.16.2021.pdf