TRAITEMENT DE L'ACNÉ
Si vous avez besoin d'aide pour accéder aux formats de rechange, tels que Portable Document Format (PDF), Microsoft Word et PowerPoint (PPT), visitez la section d'aide sur les formats de rechange.
Date
2021-06-25
AVANT-PROPOS
Cette monographie a pour objet de remplacer la Monographie sur le traitement de l'acné datée du 14 octobre 2016. La présente monographie décrit les exigences nécessaires à l'obtention d'une autorisation de mise sur le marché, à savoir d'un numéro d'identification de médicament (DIN) ou d'un numéro de produit naturel (NPN) pour des produits topiques du traitement de l'acné. La monographie indique les ingrédients médicinaux et non médicinaux autorisés, les concentrations, les indications, et les instructions et conditions relatives à l'utilisation de ces produits qui peuvent être homologués sans soumission de données supplémentaires auprès de Santé Canada. La monographie peut aussi contenir les méthodes d'analyse recommandées à utiliser conformément aux exigences de cette monographie. Les produits qui ne répondent pas aux critères énoncés dans le présent document peuvent faire l'objet d'une demande d'autorisation de mise en marché en dehors du cadre de la présente monographie.
Les demandeurs sont priés de noter que les produits de traitement l'acné, comme tout médicament sans ordonnance ou produit de santé naturel, sont assujettis au Règlement sur les aliments et drogues ou au Règlement sur les produits de santé naturels administrés par la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Ces règlements comprennent les exigences liées à l'étiquetage, à la fabrication et aux spécifications du produit. Toute information supplémentaire apparaissant sur les étiquettes, mais non spécifiée dans la monographie, telles des instructions supplémentaires et/ou des allégations non thérapeutiques, est acceptable pour autant qu'elle satisfasse aux Lignes directrices destinées à l'industrie des médicaments en vente libre et des cosmétiques concernant les allégations non thérapeutiques acceptables pour la publicité et l'étiquetage, aux Lignes directrices sur la publicité des produits de santé destinée aux consommateurs pour les médicaments en vente libre, les produits de santé naturels, les vaccins et les instruments médicaux, et qu'elle ne soit ni fausse, trompeuse ou contre-intuitive en ce qui a trait à l'utilisation du produit.
L'élaboration de la présente monographie est le résultat d'un examen approfondi des règlements, documents d'orientation, politiques et pratiques actuelles existants au sein deSanté Canada et dans d'autres organismes majeurs de réglementation.
Nota:
La présence d'une barre oblique (/) signifie que les termes et/ou les énoncés sont synonymes. Le demandeur peut sélectionner l'un ou l'autre terme ou énoncé. Le texte entre parenthèses correspond à des renseignements complémentaires facultatifs qui peuvent être inclus dans le formulaire de demande de licence de mise en marché et sur l'étiquette à la discrétion du demandeur.
INGRÉDIENTS MÉDICINAUX
Les produits de traitement de l'acné sont classés parmi les produits de santé naturels (PSN) s'ils contiennent les ingrédients énumérés au tableau 1. Les demandeurs qui sollicitent un PSN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/naturels-sans-ordonnance.html
Les produits de traitement de l'acné sont considérés comme des médicaments sans ordonnance s'ils contiennent au moins un des ingrédients du tableau 2. Les demandeurs qui sollicitent un DIN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medicaments/demandes-presentations/lignes-directrices.html
| Nom(s) propre(s) 1 | Nom(s) commun(s) 1 | Matière(s) d'origine 1 | Quantity 2 |
|---|---|---|---|
| Nom(s) commun(s) | |||
Table 1 Footnotes
|
|||
Acide 2-hydroxybenzoïque |
Acide salicylique |
Acide salicylique |
0,5 à 2% |
Soufre |
Soufre |
Soufre |
3 à 10% 3 |
|
Résorcinol |
Résorcinol |
2% 4 |
1,3-Benzènediol, monoacétate |
Monoacétate de résorcinol |
Monoacétate de résorcinol |
3% 4 |
VOIE(S) D'ADMINISTRATION
Topique
FORME(S) POSOLOGIQUE(S)
Les formes posologiques suivantes sont acceptables lorsqu'utilisées selon les exigences listées dans cette monographie :
Formes posologiques acceptables pour les médicaments sans ordonnance (MSOs) :
- Aérosol; Crème; Gel; Lotion; Onguent; Pâte; Serviette; Solution
Formes posologiques acceptables pour les produits de santé naturels (PSN) :
- Aérosol; Aérosol, pulvérisateur; Crème; Éponge; Gel; Liquide topique; Lotion; Mousse; Onguent; Pâte; Pulvérisateur; Savon, barre; Savon, liquide; Serviette, traité; Solution
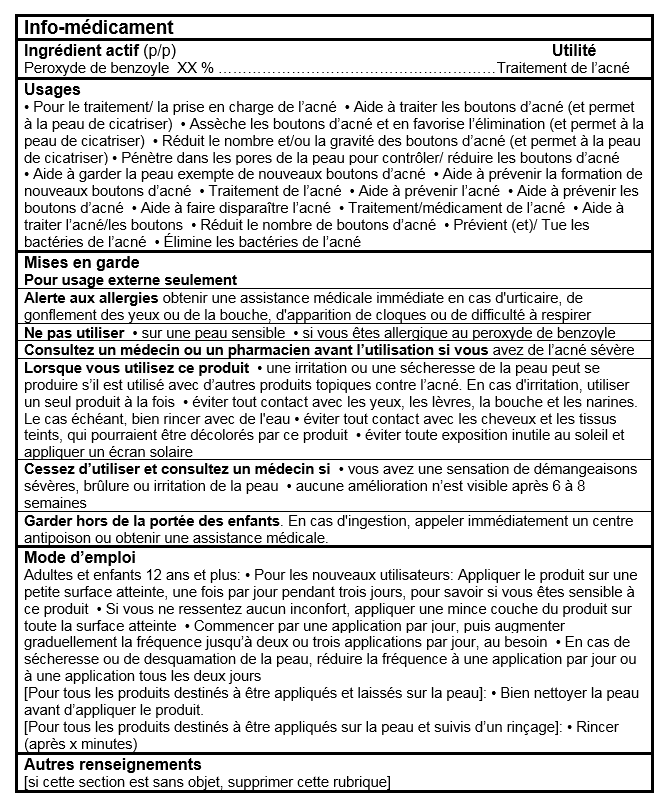
USAGE(S) OU FIN(S)
Usage(s) ou Fin(s) - Catégorie I du Cadre pour les produits d'autosoins
Pour tous les produits, les énoncés suivants peuvent être inclus:
- Pour le traitement/la prise en charge de l'acné
- Aide à traiter les boutons d'acné (et permet à la peau de cicatriser)
- Assèche les boutons d'acné et en favorise l'élimination (et permet à la peau de cicatriser)
- Réduit le nombre et/ou la gravité des boutons d'acné (et permet à la peau de cicatriser)
- Pénètre dans les pores de la peau pour contrôler/réduire les boutons d’acné
- Aide à garder la peau exempte de nouveaux boutons d'acné
- Aide à prévenir la formation de nouveaux boutons d'acné
- Traitement de l'acné
- Aide à prévenir l'acné
- Aide à prévenir les boutons d'acné
- Aide à faire disparaître l'acné
- Traitement/médicament de l'acné
- Aide à traiter l'acné/les boutons
- Réduit le nombre de boutons d'acné
Pour tous les produits contenant du Peroxyde de benzoyle, l'énoncé suivant peut être inclus:
- Prévient (et)/Tue les bactéries de l'acné
- Élimine les bactéries de l'acné
Usage(s) ou Fin(s) inacceptable(s):
Énoncé(s) précisant ce qui suit:
- Lutte contre la graisse (peau grasse)
- Guérit l'acné
- Acné sévère
Les demandes relatives aux produits qui recommandent un schéma de traitement séquentiel ou de produits offerts dans un emballage combiné avec un autre médicament sans ordonnance, produit de santé naturel ou produit cosmétique (tels que définis dans le document de ligne directrice: Étiquetage des médicaments pharmaceutiques destinés à l'usage des humains) seront examinées en dehors de la monographie.
DOSE(S)
Sous-population(s):
Adolescents de 12 à 17 ans, Adultes 18 ans et plus
Quantité:
Voir les tableaux 1 et 2.
Combinaisons permises:
Les seules combinaisons autorisées sont celles contenant du soufre et du résorcinol ou du monoacétate de résorcinol (FDA 2010):
- Soufre : De 3 à 8 % + résorcinol : 2 %
- Soufre : De 3 à 8 % + monoacétate de résorcinol : 3 %
Autres remarques : Les produits contenant du résorcinol ou du monoacétate de résorcinol en association avec du soufre ne peuvent pas être indiqués comme étant des nettoyants pour le corps ou pour le visage.
Mode d'emploi:
Pour tous les produits:
- Pour les nouveaux utilisateurs: Appliquer le produit sur une petite surface atteinte, une fois par jour pendant trois jours, pour savoir si vous êtes sensible à ce produit.
- Si vous ne ressentez aucun inconfort, appliquer une mince couche du produit sur toute la surface atteinte.
- Commencer par une application par jour, puis augmenter graduellement la fréquence jusqu'à deux ou trois applications par jour, au besoin.
- En cas de sécheresse ou de desquamation de la peau, réduire la fréquence à une application par jour ou à une application tous les deux jours.
Pour tous les produits destinés à être appliqués et laissés sur la peau:
- Bien nettoyer la peau avant d'appliquer le produit.
Pour tous les produits destinés à être appliqués sur la peau et suivis d'un rinçage:
- Rincer (après x minutes).
Pour les aérosols, les aérosols pulvérisateurs et les pulvérisateurs :
- Ne pas vaporiser directement sur le visage. Vaporiser dans les mains, puis appliquer sur le visage.
- Éviter d'inhaler ou d'exposer d'autres personnes à la vaporisation.
Durée d'utilisation:
Aucun énoncé requis.
MENTIONS DE RISQUE
Précautions et avertissements:
Pour tous les produits:
- Pour usage externe seulement
- Consultez un médecin ou un pharmacien/docteur ou pharmacien/praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé avant l'utilisation si vous avez de l'acné sévère.
- Lorsque vous utilisez ce produit une irritation ou une sécheresse de la peau peut se produire s'il est utilisé avec d'autres produits topiques contre l'acné. En cas d'irritation, utiliser un seul produit à la fois.
- Lorsque vous utilisez ce produit éviter tout contact avec les yeux. Le cas échéant, bien rincer avec de l'eau.
- Cessez d'utiliser et consultez un médecin/docteur/praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé si aucune amélioration n'est visible après 6 à 8 semaines.
- Garder hors de la portée des enfants. En cas d'ingestion, appeler immédiatement un centre antipoison ou obtenir une assistance médicale.
Pour tous les produits contenant du soufre ou du soufre en association avec du résorcinol ou du monoacétate de résorcinol:
- Lorsque vous utilisez ce produit appliquer seulement sur les surfaces acnéiques.
Pour les produits contenant du Peroxyde de benzoyle:
- Lorsque vous utilisez ce produit éviter tout contact avec les lèvres, la bouche et les narines. Le cas échéant, bien rincer avec de l'eau.
- Lorsque vous utilisez ce produit éviter tout contact avec les cheveux et les tissus teints, qui pourraient être décolorés par ce produit.
- Lorsque vous utilisez ce produit éviter toute exposition inutile au soleil et appliquer un écran solaire.
Contre-indication(s):
Pour les produits contenant du soufre ou du soufre en association avec du résorcinol ou du monoacétate de résorcinol:
- Ne pas utiliser sur une peau éraflée.
- Ne pas utiliser sur de grandes surfaces de peau.
Pour les produits contenant du Peroxyde de benzoyle:
- Ne pas utiliser sur une peau sensible.
- Ne pas utiliser si vous êtes allergique au peroxyde de benzoyle.
Réaction(s) indésirable(s) connue(s):
Pour tous les produits:
- Cessez d'utiliser et consultez un médecin/docteur/praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé si vous avez une sensation de démangeaisons sévères, brûlure ou irritation de la peau.
Pour les produits contenant du Peroxyde de benzoyle ou de l'Acide salicylique :
- Alerte aux allergies obtenir une assistance médicale immédiate en cas d'urticaire, de gonflement des yeux ou de la bouche, d'apparition de cloques ou de difficulté à respirer.
Note:
Les termes alternatifs "docteur/praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé" sont uniquement acceptables pour les PSN. Les étiquettes des médicaments vendus sans ordonnance doivent suivre les exigences listées dans le Tableau 1 du document d'orientation intitulé : Les exigences d'étiquetage pour les médicaments vendus sans ordonnance.
INGRÉDIENTS NON-MEDICINAUX
Les ingrédients doivent être sélectionnés à partir de la Base de données d'ingrédients de produits de santé naturels actuelle (BDIPSN), et doivent respecter les seuils indiqués dans cette base de données ainsi que ceux figurant dans le Règlement sur les aliments et drogues (RAD) et la Liste critique des ingrédients des cosmétiques actuelle, le cas échéant.
CONDITIONS D'ENTREPOSAGE
Aucun énoncé requis.
SPÉCIFICATIONS
La présente monographie précise les exigences particulières à la catégorie de médicaments sans ordonnance et aux PSN en question. Tout changement apporté au procédé de fabrication ayant un effet sur l'innocuité ou l'efficacité des ingrédients (par exemple, l'usage de nouvelles technologies telle que la nanotechnologie) requiert des données à l'appui qui seront examinées hors du cadre de la présente monographie.
Pour les produits contenant seulement des ingrédients médicinaux de PSN figurant au tableau 1:
Les spécifications sur les produits finis doivent être établies en accord avec les exigences décrites dans le Guide de référence sur la qualité des produits de santé naturels de la DPSNSO. Les ingrédients médicinaux doivent respecter les exigences établies dans la BDIPSN.
Pour les produits contenant des ingrédients médicinaux de médicaments sans ordonnance figurant au tableau 2:
Les produits doivent respecter les exigences du Règlement de la Loi sur les aliments et drogues.
TABLEAUX D'INFORMATION SUR LES MÉDICAMENTS (Format facultatif pour les produits de Catégorie I dans le Cadre pour les produits d'autosoins)
RÉFÉRENCES
AHFS 2015: American Hospital Formulary Service®. McEvoy GK (ed). AHFS Drug Information 2015®. [Internet] Published by Authority of the Board of the American Society of Health-System Pharmacists®, Bethesda, Maryland. [Accessed 2015 October 07]. Available from: http://online.statref.com
Krinsky DL, Ferreri SP, Hemstreet B, Hume AL, Newton GD, Rollins CJ, Tietze KJ. Handbook of Nonprescription Drugs: An interactive approach for Self-Care, 18th edition. Washington (DC): American Pharmaceutical Association; 2015.
FDA 2015: USA Department of Health and Human Services: Food and Drug Administration, 2015 21CFR 333 Subpart D Topical Acne Drug Products. Available from http://www.ecfr.gov/cgi-bin/text-idx?SID=7dd575d6469c84663037eefaae4d0abe&mc=true&node=pt21.5.333&rgn=div5#sp21.5.333.d. [Accessed 2016.07.25].
FDA 2011: USA Department of Health and Human Services: Food and Drug Administration, 2011 Guidance for Industry OTC Acne Product Compliance guide
FDA 2010: USA Department of Health and Human Services: Food and Drug Administration, 2010. 21 CFR Part 333. Classification of Benzoyl Peroxide as Safe and Effective and Revision of Labeling to Drug Facts Format; Topical Acne Drug Products for Over-the-Counter Human Use, Final Rule. [Accessed 2015.09.22].
O'Neil MJ, Smith A, Heckelman PE, Budavari S, editors. Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 2018 Whitehouse Station (NJ): Merck & Co., Inc; 2018.
Sweetman SC, editor. Martindale: The Complete Drug Reference. Online edition. Pharmaceutical Press; 2015 [Accessed 2015.10.07].
USP 38: The United States Pharmacopeia and the National Formulary (USP 38/NF 33). Rockville (MD): United States Pharmacopeial Convention, Inc.; 2015.