Produits de Traitement de l'Érythème Fessier
Si vous avez besoin d'aide pour accéder aux formats de rechange, tels que Portable Document Format (PDF), Microsoft Word et PowerPoint (PPT), visitez la section d'aide sur les formats de rechange.
Date
2024-02-23
Avant-propos
Cette monographie a pour objet de remplacer la Monographie sur les produits de traitement de l'érythème fessier datée du 7 décembre 2018. La présente monographie décrit les exigences nécessaires à l'obtention d'une autorisation de mise sur le marché, à savoir d'un numéro d'identification de médicament (DIN) ou d'un numéro de produit naturel (NPN) pour des produits de traitement de l'érythème fessier. La monographie indique les ingrédients médicinaux et non médicinaux autorisés, les concentrations, les indications, et les instructions et conditions relatives à l'utilisation de ces produits qui peuvent être homologués sans soumission de données supplémentaires auprès de Santé Canada. Les produits qui ne répondent pas aux critères énoncés dans le présent document peuvent faire l'objet d'une demande d'autorisation de mise en marché en dehors du cadre de la présente monographie.
Les demandeurs sont priés de noter que les produits de traitement de l'érythème fessier, comme tout médicament sans ordonnance ou produit de santé naturel, sont assujettis au Règlement sur les aliments et drogues ou au Règlement sur les produits de santé naturels administré par la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Ces règlements comprennent les exigences liées à l'étiquetage, à la fabrication et aux spécifications du produit. Toute information supplémentaire apparaissant sur les étiquettes, mais non spécifiée dans la monographie, telles des instructions supplémentaires et/ou des allégations non thérapeutiques, est acceptable pour autant qu'elle satisfasse aux Lignes directrices destinées à l'industrie des médicaments en vente libre et des cosmétiques concernant les allégations non thérapeutiques acceptables pour la publicité et l'étiquetage, aux Lignes directrices sur la publicité des produits de santé destinée aux consommateurs pour les médicaments en vente libre, les produits de santé naturels, les vaccins et les instruments médicaux, et qu'elle ne soit ni fausse, trompeuse ou contre-intuitive en ce qui a trait à l'utilisation du produit.
Notes
- Les parenthèses contiennent des éléments d'information additionnels (facultatifs) qui peuvent être inclus dans le formulaire de demande de licence de mise en marché et sur l'étiquette du produit à la discrétion du demandeur.
- La barre oblique (/) indique que les termes et/ou énoncés sont synonymes. Le demandeur peut utiliser n'importe lequel des termes ou énoncés indiqués.
Ingrédients médicinaux
Les produits de traitement de l'érythème fessier sont classés parmi les produits de santé naturels (PSN) s'ils contiennent les ingrédients énumérés aux tableaux 1 et 2. Les demandeurs qui sollicitent un PSN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/en/health-canada/services/drugs-health-products/natural-non-prescription.html.
Les produits de traitement de l'érythème fessier sont considérés comme des médicaments sans ordonnance (MSO) s'ils contiennent au moins un des ingrédients du tableau 3 à la quantité indiquée dans le tableau. Les demandeurs qui sollicitent un DIN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/medicaments/demandes-presentations/lignes-directrices.html
| Nom(s) propre(s)1 | Nom(s) commun(s)1 | Information(s) d'origine1 | Quantité2 | |||
|---|---|---|---|---|---|---|
| Matière(s) d'origine - ingrédient(s) | Matière(s) d'origine | Partie(s) | Préparation(s) | |||
| (2,5-Dioxo-4- imidazolidinyl) urée |
|
S/O | Allantoïne3 | S/O | S/O | 0,5 à 2% |
| Kaolin |
|
S/O | Kaolin3 | S/O | S/O | 4 à 20% |
| Oxyde de fer (Fe2O3), Mélange avec de l'oxyde de zinc | Calamine | S/O | Calamine3 | S/O | S/O | 1 à 25% |
| Oxyde de zinc |
|
S/O | Oxide de zinc3 | S/O | S/O |
1 à 25% (Oxyde de zinc) 25 à 40% (Pommade à base d'oxyde de zinc) |
| Zea mays |
|
Zea mays3 | S/O | Graine | Séchée | 10 à 98% |
1 Au moins une de ces références a été consultée
pour
les
noms propres, noms communs et matières d'origine: RSC 2024; USP-NF
2023;
Sweetman 2017; Nikitakis et Lange 2016.
2 Au moins une des références suivantes a été
consultée
pour la dose: US FDA 2021; Krinsky 2017; Sweetman 2017; Leung et Foster
2010.
3 L'ingrédient doit respecter les normes des pharmacopées.
| Nom(s) propre(s)1 | Nom(s) commun(s)1 | Information(s) d'origine1 | Quantité2 | ||
|---|---|---|---|---|---|
| Matière(s) d'origine | Groupe(s) d'organismes | Partie(s) | |||
| Huile de foie de morue |
|
S/O |
|
Foie | 5 à 14% |
|
|
Ovis aries | S/O | Laine | 15,5% |
1 Au moins une de ces références a été consultée
pour
les
noms propres, noms communs et matières d'origine: RSC 2024; USP-NF
2023;
Sweetman 2017; Nikitakis and Lange 2016;.
2 La référence suivante a été consultée pour la
dose:
US
FDA 2021.
3 L'huile de foie de morue et la lanoline ne sont pas autorisées en
tant
qu'ingrédients médicinaux uniques, car ces ingrédients ne
suffisent pas à eux seuls à appuyer l'efficacité du produit.
4 La quantité de vitamine A et de vitamine D fournie par l'huile de
foie de
morue dans le produit ne doit pas dépasser 3000 µg EAR vitamine A (10
000
IU) et 10 µg vitamine D/cholécalciférol (400 IU) par jour (US FDA
2021).
| Nom(s) propre(s) | Nom(s) commun(s) | Quantité |
|---|---|---|
|
Diméthicone | 1 à 30% |
| Huile minérale |
|
50 à 100% |
| Pétrolatum |
|
30 à 100% |
| Pétrolatum blanc |
|
30 à 100% |
1 Consulter les combinaisons permises.
Voie(s) d'administration
Topique
Forme(s) posologique(s)
Formes posologiques acceptables pour les PSN
- Baume; Crème; Gel; Huile; Liquide topique; Lotion; Onguent; Pâte; Poudre; Serviette, médicamentée; Solution
Formes posologiques acceptables pour les MSO
- Crème; Gel; Huile; Lotion; Onguent; Pâte; Serviette; Solution
Usage(s) ou fin(s)
Usage(s) ou Fin (s) - Catégorie I du Cadre pour les produits d'autosoins
Pour tous les produits avec un ingrédient du tableau 1 ou 3:
- Aide à prévenir l'érythème fessier (US FDA 2021).
- Protège la peau légèrement irritée/les irritations mineures de la peau causée(s) par l'érythème fessier (US FDA 2021).
- Aide à protéger contre la moiteur qui cause l'érythème fessier (US FDA 2021).
- Aide à soulager temporairement les irritations mineures de la peau causées par l'érythème fessier (US FDA 2021).
- Aide à traiter/soigner l'érythème fessier (US FDA 2021).
Dose(s)
Sous-population(s):
Nourrissons de 0 à 1 ans, Enfants de 2 à 11 ans, Adolescents de 12 à 17 ans, Adultes 18 ans et plus.
Quantité:
Voir les tableaux 1, 2 et 3.
Combinaisons permises:
- N'importe lesquels des ingrédients énumérés dans les tableaux 1, 2, et/ou 3 peuvent être combinés, pourvu que la concentration de chaque ingrédient ne dépasse pas les limites indiquées (US FDA 2021).
Mode d'emploi:
Pour tous les produits:
- Appliquer généreusement sur une peau propre et sèche, au besoin (US FDA 2021).
Durée d'utilisation:
Aucun énoncé requis.
Mention(s) de risque
Précautions et avertissements:
Pour tous les produits:- Pour usage externe seulement (US FDA 2021).
- Lorsque vous utilisez ce produit éviter tout contact avec les yeux. Le cas échéant, bien rincer avec de l'eau (US FDA 2021).
- Cessez d'utiliser et consultez un praticien de soins de santé/fournisseur de soins de santé/professionnel de la santé docteur/médecin si les symptômes s'aggravent, durent plus de 7 jours, ou reviennent après quelques jours (US FDA 2021).
- Garder hors de la portée des enfants. En cas d'ingestion, appelez un centre antipoison ou obtenir une assistance médicale immédiate.
- Lorsque vous utilisez ce produit gardez la poudre éloignée de la figure afin d'éviter d'inhaler le produit, ce qui peut provoquer des problèmes respiratoires (US FDA 2021).
Contre-indication(s):
Pour tous les produits en poudre:
- Ne pas utiliser sur une peau éraflée (US FDA 2021).
Réaction(s) indésirable(s) connue(s):
Aucun énoncé requis.
Ingrédients non-medicinaux
Les ingrédients doivent être sélectionnés à partir de la Base de données d'ingrédients de produits de santé naturels actuelle (BDIPSN), et doivent respecter les seuils indiqués dans cette base de données ainsi que ceux figurant dans le Règlement sur les aliments et drogues et la Liste critique des ingrédients des cosmétiques actuelle, le cas échéant.
Conditions d'entreposage
Doivent être établies conformément aux exigences décrites dans le Règlement sur les produits de santé naturels et le Règlement sur les aliments et drogues.
Spécifications
La présente monographie précise les exigences particulières à la catégorie de médicaments sans ordonnance et aux PSN en question.
Tout changement apporté au procédé de fabrication ayant un effet sur l'innocuité ou l'efficacité des ingrédients (par exemple, l'usage de nouvelles technologies telle que la nanotechnologie) requiert des données à l'appui qui seront examinées hors du cadre de la présente monographie.
Pour les produits contenant seulement des ingrédients médicinaux de PSN figurant aux tableaux 1 et 2:
Les spécifications sur les produits finis doivent être établies en accord avec les exigences décrites dans le Guide de référence sur la qualité des produits de santé naturels du DPSNSO.Les ingrédients médicinaux doivent respecter les exigences établies dans la BDIPSN
Pour les produits contenant des ingrédients médicinaux de MSO figurant au tableau 3:
Les produits doivent respecter les exigences du Règlement de la Loi sur les aliments et drogues.
Pour les produits contenant seulement des ingrédients médicinaux de PSN figurant aux tableaux 1 et 2:
EXEMPLE D'INFO-PRODUIT :
Veuillez consulter la ligne directrice, Étiquetage des produits de santé naturels pour plus de détails.
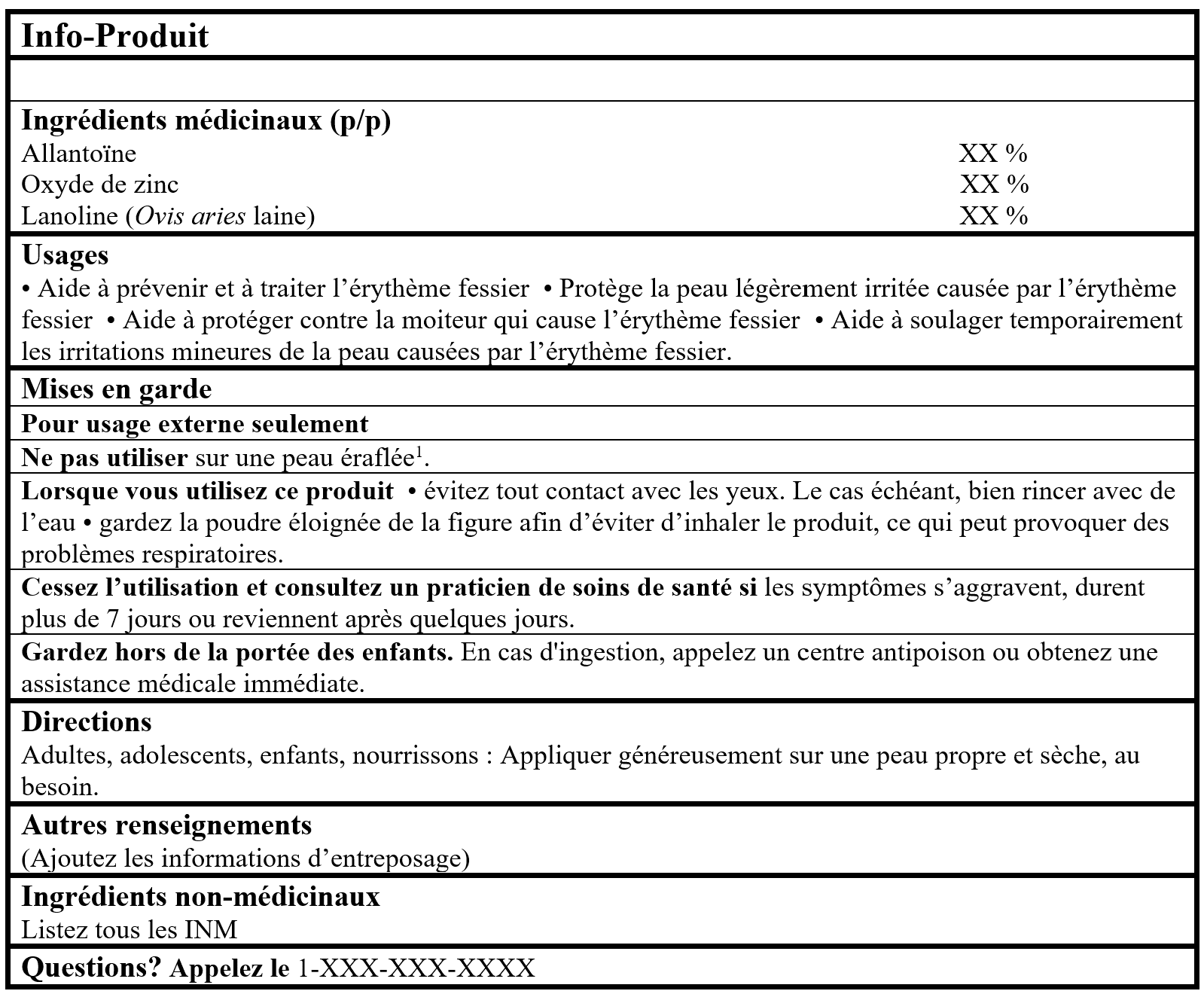
1Pour les produits en poudre
Pour les produits contenant des ingrédients médicinaux de MSO figurant au tableau 3 :
TABLEAU D'INFORMATION SUR LES MÉDICAMENTS (Format facultatif pour les produits de Catégorie I dans le Cadre pour les produits d'autosoins)




References
- Krinsky DL, Ferreri SP, Hemstreet B, Hume AL, Newton GD, Rollins CJ, Tietze KJ. Handbook of Nonprescription Drugs: An interactive approach for Self-Care, 19e édition. Washington (DC): American Pharmaceutical Association; 2017.
- Leung AY, Foster S. Encyclopedia of Common Natural Ingredients Used in Food, Drugs, and Cosmetics, 3e édition. Hoboken (NJ): John Wiley and Sons, Inc.; 2010.
- Nikitakis J, Lange B, editeurs. International Cosmetic Ingredient Dictionary and Handbook. 16e édition. Washington (DC): Cosmetic, Toiletry and Fragrance Association; 2016.
- RSC 2024: Royal Society of Chemistry: The Merck Index Online [Consulté le 16 janvier 2024]. Disponible à: https://merckindex.rsc.org/
- Sweetman SC, editeur. Martindale: The Complete Drug Reference, 39e édition. Grayslake (IL): Pharmaceutical Press; 2017.
- US FDA 2021: U.S. Food and Drug Administration. 21 CFR Part 347. Over-the-Counter (OTC) Monograph M016: Skin Protectant Drug Products for Over-the-Counter Human Use 2021. [Accessed February 2, 2024] Available from: https://www.accessdata.fda.gov/drugsatfda_docs/omuf/OTCMonograph_M016SkinProtectantDrugProductsforOTCHumanUse09242021.pdf.
- USP-NF 2023: United States Pharmacopeia and the National Formulary. Rockville (MD): United States Pharmacopeial Convention, Inc.; 2023.