Produits Antipelliculaires
Si vous avez besoin d'aide pour accéder aux formats de rechange, tels que Portable Document Format (PDF), Microsoft Word et PowerPoint (PPT), visitez la section d'aide sur les formats de rechange.
Date
2018-12-07
AVANT-PROPOS
Cette monographie a pour objet de remplacer la Monographie sur les produits antipelliculaires datée du 12 Octobre 2006. La présente monographie décrit les exigences nécessaires à l'obtention d'une autorisation de mise sur le marché, à savoir d'un numéro d'identification de médicament (DIN) ou d'un numéro de produit naturel (NPN) pour des produits topiques d'application sur le cuir chevelu pour le contrôle des pellicules. La monographie indique les ingrédients médicinaux et non médicinaux autorisés, les concentrations, les indications, et les instructions et conditions relatives à l'utilisation de ces produits qui peuvent être homologués sans soumission de données supplémentaires auprès de Santé Canada. La monographie peut aussi contenir les méthodes d'analyse recommandées à utiliser conformément aux exigences de cette monographie. Les produits qui ne répondent pas aux critères énoncés dans le présent document peuvent faire l'objet d'une demande d'autorisation de mise en marché en dehors du cadre de la présente monographie.
Les demandeurs sont priés de noter que les produits antipelliculaires comme tout médicament sans ordonnance ou produit de santé naturel, sont assujettis au Règlement sur les aliments et drogues ou au Règlement sur les produits de santé naturels administré par la Direction des produits de santé naturels et sans ordonnance (DPSNSO). Ces règlements comprennent les exigences liées à l'étiquetage, à la fabrication et aux spécifications du produit. Toute information supplémentaire apparaissant sur les étiquettes, mais non spécifiée dans la monographie, telles des instructions supplémentaires et/ou des allégations non thérapeutiques, est acceptable pour autant qu'elle satisfasse aux Lignes directrices destinées à l'industrie des médicaments en vente libre et des cosmétiques concernant les allégations non thérapeutiques acceptables pour la publicité et l'étiquetage, aux Lignes directrices sur la publicité des produits de santé destinée aux consommateurs pour les médicaments en vente libre, les produits de santé naturels, les vaccins et les instruments médicaux, et qu'elle ne soit ni fausse, trompeuse ou contre-intuitive en ce qui a trait à l'utilisation du produit.
L'élaboration de la présente monographie est le résultat d'un examen approfondi des règlements, documents d'orientation, politiques et pratiques actuelles existants au sein deSanté Canada et dans d'autres organismes majeurs de réglementation.
Note
La présence d'une barre oblique (/) signifie que les termes et/ou les énoncés sont synonymes. Le demandeur peut sélectionner l'un ou l'autre terme ou énoncé. Le texte entre parenthèses correspond à des renseignements complémentaires facultatifs qui peuvent être inclus dans le formulaire de demande de licence de mise en marché et sur l'étiquette à la discrétion du demandeur.
INGRÉDIENTS MÉDICINAUX
Les produits antipelliculaires sont classés parmi les produits de santé naturels (PSN) s'ils contiennent seulement un ou des ingrédient(s) énumérés au tableau 1. Les demandeurs qui sollicitent un PSN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/naturels-sans-ordonnance.html.
Les produits antipelliculaires sont classés parmi les médicaments sans ordonnance s'ils contiennent un des produits énumérés au tableau 2. Les demandeurs qui sollicitent un DIN peuvent se reporter aux formulaires et aux documents de référence appropriés en visitant le site https://www.canada.ca/en/health-canada/services/drugs-health-products/drug-products/applications-submissions/guidance-documents.html.
| Proper name(s)1 | Common name(s)1 | Source material(s)1,2 | Quantity3 |
|---|---|---|---|
| Common name(s) | |||
Table 1 Footnotes
|
|||
Acide 2-hydroxybenzoïque |
Acide salicylique |
Acide salicylique |
1,8 à 3,0% |
Disulfure de sélénium |
Disulfure de sélénium |
Disulfure de sélénium |
0,5 à 2,5% |
Soufre |
Soufre |
Soufre |
2 à 5% |
VOIE(S) D'ADMINISTRATION
Topique
FORME(S) POSOLOGIQUE(S)
Les formes posologiques acceptables pour les catégories d'âge listées dans cette monographie et pour la voie d'administration spécifiée sont indiquées dans le document de référence Compendium des monographies.
USAGE(S) OU FIN(S)
Usages ou fins - Catégorie I du Cadre pour les produits d'autosoins
Pour les produits énumérés dans le tableau 1 ou tableau 2:
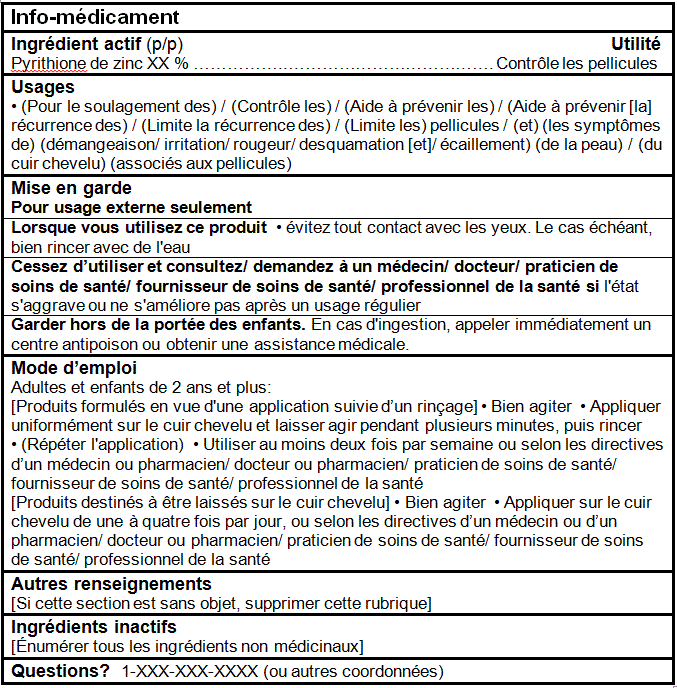
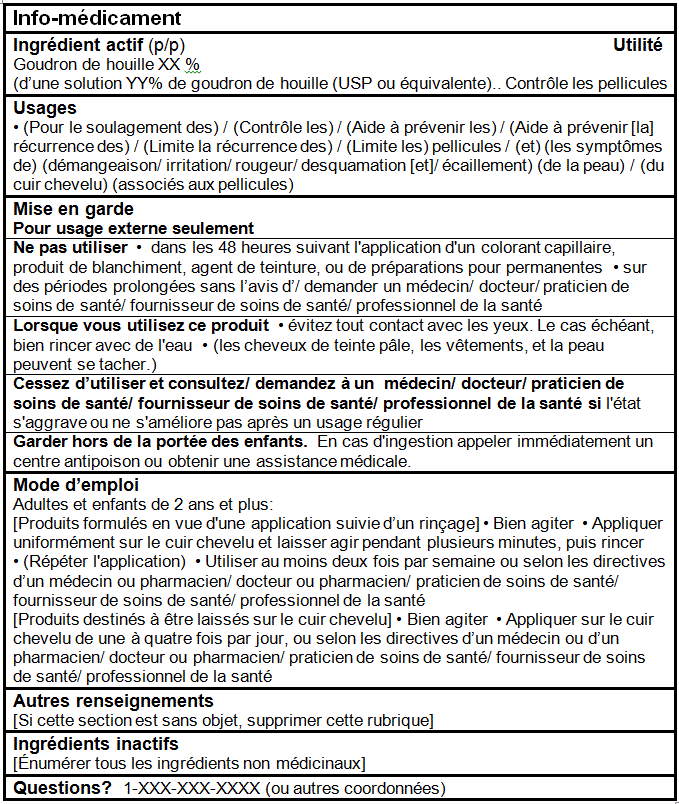
- (Pour le soulagement des) / (Contrôle les) / (Aide à prévenir les) / (Aide à prévenir [la] récurrence des) / (Limite la récurrence des) / (Limite les) pellicules / (et) (les symptômes de) (démangeaison/ irritation/ rougeur/ desquamation [et]/ écaillement) (de la peau) / (du cuir chevelu) (associés aux pellicules) (FDA 2007)
DOSE(S)
Sous-population(s):
Enfants de 2 à 11 ans, Adolescents de 12 à 17 ans, Adultes 18 ans et plus
Quantité:
Voir les tableaux 1 et 2.
Combinaisons permises:
Les seules combinaisons permises sont :
- l'acide salicylique et le soufre: 1,8% à 3% d'acide salicylique et 2% à 5% de soufre (Gupta et Nicol 2004).
- La houille de goudron et le dl/l-menthol (seulement dans les produits à être appliqués puis rincés après une brève exposition):1,8% de goudron de houille et 1,5% de dl/l-menthol (FDA 2007).
Mode(s) d'emploi:
Pour les produits formulés en vue d'une application suivie d'un rinçage:
- (Agiter bien.)
- Appliquer uniformément sur le cuir chevelu, laisser agir plusieurs minutes, puis rincer. (Répéter l'application) (Sweetman 2017).
- Utiliser le produit au moins deux fois par semaine ou selon les directives d'un médecin ou pharmacien/ docteur ou pharmacien/ praticien de soins de santé/ fournisseur de soins de santé/ professionnel de la santé (FDA 2007).
Pour les produits destinés à être appliqués et laissés sur le cuir chevelu:
- (Agiter bien.)
- Appliquer sur le cuir chevelu de une à quatre fois par jour, ou selon les directives d'un médecin ou pharmacien/ docteur ou pharmacien/ praticien de soins de santé/ fournisseur de soins de santé/ professionnel de la santé (FDA 2007).
Durée d'utilisation:
Aucun énoncé requis.
MENTIONS DE RISQUE
Précautions et avertissements:
Pour tous les produits:
- Pour usage externe seulement (Sweetman 2017; FDA 2007)
- Lorsque vous utilisez ce produit éviter tout contact avec les yeux. Le cas échéant, bien rincer avec de l'eau (FDA 2007).
- Cessez d'utiliser et consultez/ demandez à un médecin/ docteur/ praticien de soins de santé/ fournisseur de soins de santé/ professionnel de la santé si l'état s'aggrave ou ne s'améliore pas après un usage régulier (FDA 2007).
- Garder hors de la portée des enfants. En cas d'ingestion, appeler immédiatement un centre antipoison ou obtenir une assistance médicale.
Pour les produits contenant du goudron de houille:
- (Lorsque vous utilisez ce produit les cheveux de teinte pâle, les vêtements, et la peau peuvent se tacher.)
Contre-indications:
Pour les produits contenant du sulfure de sélénium ou du goudron de houille:
- Ne pas utiliser dans les 48 heures suivant l'application d'un colorant capillaire, produit de blanchiment, agent de teinture, ou de préparations pour permanentes (Krinsky et al. 2017 ; Sweetman 2017; CTMA 2016, CPMA 2016).
Pour les produits contenant du goudron de houille:
- Ne pas utiliser sur des périodes prolongées sans l'avis d'/ demander un médecin/ docteur/ praticien de soins de santé/ fournisseur de soins de santé/ professionnel de la santé.
Réaction(s) indésirable(s) connue(s):
Aucun énoncé requis.
INGRÉDIENTS NON-MÉDICINAUX
Les ingrédients doivent être sélectionnés à partir de la Base de données d'ingrédients de produits de santé naturels actuelle (BDIPSN), et doivent respecter les seuils indiqués dans cette base de données ainsi que ceux figurant dans le Règlement sur les aliments et drogues (RAD) et la Liste critique des ingrédients des cosmétiques actuelle, le cas échéant.
CONDITIONS D'ENTREPOSAGE
Aucun énoncé requis.
SPÉCIFICATIONS
La présente monographie précise les exigences particulières à la catégorie de médicaments sans ordonnance et aux PSN en question. Tout changement apporté au procédé de fabrication ayant un effet sur l'innocuité ou l'efficacité des ingrédients (par exemple, l'usage de nouvelles technologies telle que la nanotechnologie) requiert des données à l'appui qui seront examinées hors du cadre de la présente monographie
Pour les produits contenant seulement des ingrédients médicinaux de PSN figurant au tableau 1:
Les spécifications sur les produits finis doivent être établies en accord avec les exigences décrites dans le Guide de référence sur la qualité des produits de santé naturels du DPSNSO.Les ingrédients médicinaux doivent respecter les exigences établies dans le BDIPSN
Pour les produits contenant des ingrédients médicinaux de médicaments sans ordonnance figurant au tableau 2:Les produits doivent respecter les exigences du Règlement de la Loi sur les aliments et drogues.
TABLEAU D’INFORMATION SUR LES MÉDICAMENTS (Format facultatif pour les produits de Catégorie I dans le Cadre pour les produits d’autosoins)
References
BP 2018: The British Pharmacopoeia. British Pharmacopoeia Commission. London (UK): Her Majesty's Stationary Office; 2018
Compendium of products for minor ailments (CPMA). Power B, et al., éditeurs. Canadian Pharmacists Association ; 2016
Compendium of therapeutics for minor ailments (CTMA). Power B et al., éditeurs. Canadian Pharmacists Association ; 2016
FDA 2007: USA Department of Health and Human Services: Food and Drug Administration. 21 CFR 358. Dandruff, seborrheic dermatitis, and psoriasis drug products for over-the-counter human use: final rule; 2007. [Consulté le 2018-05-11]. Disponible en ligne à : http://www.fda.gov/cder/otcmonographs/Dandruff&Seborrheic_Dermatitis&Psoriasis/dandruff(3 58H).pdf
Gupta AK, Nicol K. The use of sulfur in dermatology. Journal of drugs in dermatology. 2004; 3:427-431.
Krinsky DL, Ferreri SP, Hemstreet B, Hume AL, Newton GD, Rollins CJ, Tietze KJ. Handbook of Nonprescription Drugs: An interactive approach for Self-Care, 19ième édition. Washington (DC): American Pharmaceutical Association; 2017 (Chapter 34)
Lignes directrices sur la publicité des produits de santé destinée aux consommateurs pour les médicaments en vente libre, les produits de santé naturels, les vaccins et les instruments médicaux. Normes de publicité. 2018
Lignes directrices destinées à l'industrie des médicaments en vente libre et des cosmétiques concernant les allégations non thérapeutiques acceptables pour la publicité et l'étiquetage. Normes de publicité 2016
Nikitakis J, Lange B, éditeurs. International Cosmetic Ingredient Dictionary and Handbook.16ième édition. Washington (DC): Cosmetic, Toiletry and Fragrance Association; 2016
O'Neil MJ, Smith A, Heckelman PE, Budavari S, éditeurs. Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 2018. Whitehouse Station (NJ): Merck & Co., Inc; 2018.
Santé Canada 2015: Guide de référence sur la qualité des produits de santé naturels. Santé Canada, mai 2015. [Consulté le 27 septembre 2018]. Disponible à: https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/naturels-sans-ordonnance/legislation-lignes-directrices/documents-reference/guide-qualite.html
Sweetman SC, éditeurs. Martindale: The Complete Drug Reference, 39ième édition. Grayslake (IL): Pharmaceutical Press; 2017.
USP 41: The United States Pharmacopeia and the National Formulary (USP 41/NF 36). Rockville (MD): United States Pharmacopeial Convention, Inc.; 2018.